PNO - Theo trang web chính thức của Tổ chức Y tế thế giới (WHO), bộ kit xét nghiệm LightPower iVASARS-CoV-2 1stRT-rPCR Kit do Công ty cổ phần công nghệ Việt Á sản xuất chưa đủ điều kiện phê duyệt.
| Chia sẻ bài viết: |

Bi kịch của cô gái người Đức bị cáo buộc quỷ ám

Lịch sử bí ẩn của những hội kín kết nối người âm tại Mỹ

Cuộc sống của bóng hồng sau lưng các phi hành gia

Ký ức kinh hoàng của người phụ nữ thử thức ăn cho Hitler

Những vùng đất cuối cùng trên thế giới cho phép phụ nữ có nhiều chồng

Cái kết buồn cho người đàn ông tự chôn sống trong 61 ngày
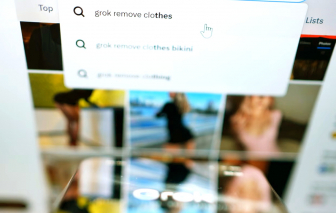
Evie hốt hoảng khi thấy những bức ảnh cô mặc trang phục kín đáo đã bị công cụ AI tên là Grok chỉnh sửa thành mặc bikini.
Nghiên cứu ở Đức cho thấy, nhiều phát hiện trước đó về những hạt vi nhựa trong não và nội tạng người rất có thể có sai sót.

Cựu Tổng thống Hàn Quốc Yoon Suk Yeol bị kết án 5 năm tù trong phán quyết đầu tiên liên quan đến thiết quân luật hồi tháng 12/2024.

Vụ sập bãi rác gây chết người mới đây tại Philippines đã phơi bày những lỗ hổng trong quản lý và thực thi luật môi trường.

Khi những cánh rừng già biến mất, loài muỗi không chết đi - chúng thích nghi và quay sang tấn công con người.

Tổng thống Mỹ Donald Trump ca ngợi nhà lãnh đạo phe đối lập Venezuela María Corina Machado vì bà trao tặng huy chương giải Nobel Hòa bình 2025 cho ông.

Ashley St Clair, mẹ của một trong các con trai của Elon Musk, đã đệ đơn kiện công ty trí tuệ nhân tạo xAI tại Tòa án Tối cao bang New York.

Các mô hình AI đã thất bại trong việc đưa ra lời khuyên thỏa đáng về câu hỏi liên quan đến sức khỏe phụ nữ.

Trẻ em tại Malaysia đang ngày càng chịu ảnh hưởng nặng nề từ các rối loạn lo âu, xu hướng này chưa có dấu hiệu chững lại.

Những tiến bộ vượt bậc trong nghiên cứu và điều trị đang giúp ngày càng nhiều bệnh nhân ung thư kéo dài sự sống.

Ngày 14/1, nền tảng X của tỷ phú Elon Musk công bố các biện pháp ngăn chặn chatbot AI Grok tạo ra hình ảnh khiêu dâm của phụ nữ và trẻ em.

Bộ Ngoại giao Mỹ cho biết việc tạm dừng xử lý visa là một phần trong chiến dịch siết chặt vấn đề nhập cư của chính phủ.

Các chuyên gia cảnh báo, tình hình suy giảm dân số vẫn tiếp diễn đang đe dọa hàng chục trường đại học ở xứ kim chi.

Ngân hàng Thế giới (WB) đã phát hiện ra rằng 1/4 số quốc gia đang phát triển nghèo hơn so với năm 2019, trước khi đại dịch COVID-19 bùng phát.

Một thói quen quen thuộc lại mang đến lợi ích sức khỏe tinh thần lâu dài cho các bà mẹ, đó là cho con bú.

Ít nhất 22 người thiệt mạng sau khi cần cẩu rơi đúng vào đoàn tàu hỏa của Thái Lan đang đi qua.

Sau cuộc hội đàm chính thức, Thủ tướng Nhật Bản Sanae Takaichi và Tổng thống Hàn Quốc Lee Jae Myung đã gây bất ngờ khi cùng nhau chơi trống với nhạc K-pop.

Các nhà chức trách Iran khẳng định họ đã giành lại quyền kiểm soát đất nước sau những đêm biểu tình rầm rộ liên tiếp sau hơn 2 tuần bất ổn.