PNO - Cơ quan Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) cho biết, họ sẽ yêu cầu các chuyên gia bên ngoài cơ quan họp vào cuối tháng 11 để xem xét kỹ lưỡng thuốc viên điều trị COVID-19 của hãng dược Merck.
| Chia sẻ bài viết: |

"Phiên chợ 0 đồng" tại Bệnh viện Nhi Trung ương mang tết đến bệnh nhi - nơi món quà nhỏ xoa dịu nỗi lo, thêm niềm tin cho gia đình đón xuân.

Những ngày qua, phía trước của Bệnh viện Nhân dân Gia Định cơ sở 2 (chi nhánh Sài Gòn) trở nên nhộn nhịp khi nhiều người rủ nhau đến "check-in" tết.

Theo chuyên gia, thuốc giải rượu không làm nồng độ cồn trong máu giảm nhanh. Trong khi cơ thể có thể hồi phục tốt bằng những thực phẩm lành mạnh, dễ kiếm.

Ngày 6/2, khoa Thận nhân tạo Bệnh viện Chợ Rẫy phối hợp cùng các mạnh thường quân tặng 20 phần quà và lì xì cho 487 bệnh nhân

Sáng 6/2, hàng trăm bệnh nhân, thân nhân và nhân viên y tế tại Bệnh viện Chợ Rẫy đã đón tết sớm ở đường hoa xuân bệnh viện.

Toàn bộ các vấn đề mà làn da thường gặp sẽ được bác sĩ da liễu giải đáp trong chuỗi talkshow này.

BHXH TPHCM ban hành các văn bản hướng dẫn nhằm bảo đảm quyền lợi khám, chữa bệnh (KCB) BHYT của người tham gia sau sáp nhập.
Theo Tổ chức Y tế thế giới (WHO), hơn 1/3 số ca ung thư trên toàn cầu thực chất có thể phòng ngừa được.

Cận tết, thực phẩm không rõ nguồn gốc, đồ ăn nhà làm được rao bán tràn lan trên mạng xã hội với quảng cáo ngon, rẻ, tiện dụng.
Mới đây, các bác sĩ chuyên khoa luân phiên đợt 6 tại Côn Đảo đã điều trị thành công một ca bệnh nặng, nguy cơ tử vong cao.

Bộ Y tế yêu cầu Trung tâm Kiểm dịch y tế quốc tế các tỉnh thành,Trung tâm Kiểm soát bệnh tật tỉnh thành tăng cường công tác kiểm dịch y tế.

Nguy cơ mất con ở một số phụ nữ có thể bắt nguồn từ những thay đổi di truyền diễn ra khi chính họ còn đang nằm trong bụng mẹ.

Trước nguy cơ thực phẩm bẩn dịp tết, Bộ Y tế cho biết đã triển khai nhiều giải pháp kiểm soát, siết chặt quản lý, bảo đảm thực phẩm.
Mang song thai nhưng sản phụ 23 tuổi phải đối mặt đồng thời 3 nguy cơ nghiêm trọng, đe dọa tính mạng cả mẹ và con...

Với bác sĩ Ngô Mộng Hùng, TikTok còn là lan tỏa nội dung tích cực tới cho khán giả, thông qua những điều bình dị nhất.

Từ phản ánh của báo chí, Sở ATTP TPHCM kiểm tra đột xuất nhiều cơ sở, phát hiện thực phẩm quá hạn và mở rộng kiểm tra toàn chuỗi cung ứng.
Sáng 4/2, thông tin từ Bệnh viện Hữu nghị Việt Đức, đơn vị này vừa tiếp nhận một cụ bà bị chó tấn công nguy hiểm tính mạng.
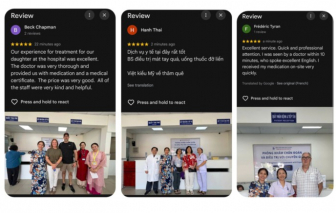
Không chỉ nhận được sự tin tưởng của người dân thành phố, mà còn thu hút khách nước ngoài, Việt kiều đến khám, điều trị và đánh giá cao.