PNO - Ranitidine (thường được biết đến với tên thương mại Zantac) được sử dụng trong điều trị bệnh loét dạ dày tá tràng, bệnh trào ngược dạ dày thực quản.
| Chia sẻ bài viết: |
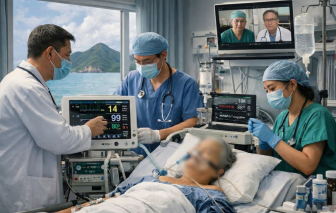
Mới đây, các bác sĩ chuyên khoa luân phiên đợt 6 tại Côn Đảo đã điều trị thành công một ca bệnh nặng, nguy cơ tử vong cao.

Bộ Y tế yêu cầu Trung tâm Kiểm dịch y tế quốc tế các tỉnh thành,Trung tâm Kiểm soát bệnh tật tỉnh thành tăng cường công tác kiểm dịch y tế.

Nguy cơ mất con ở một số phụ nữ có thể bắt nguồn từ những thay đổi di truyền diễn ra khi chính họ còn đang nằm trong bụng mẹ.

Trước nguy cơ thực phẩm bẩn dịp tết, Bộ Y tế cho biết đã triển khai nhiều giải pháp kiểm soát, siết chặt quản lý, bảo đảm thực phẩm.
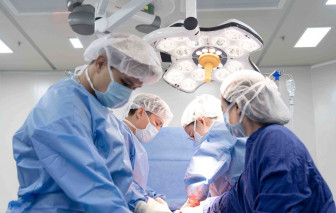
Mang song thai nhưng sản phụ 23 tuổi phải đối mặt đồng thời 3 nguy cơ nghiêm trọng, đe dọa tính mạng cả mẹ và con...

Với bác sĩ Ngô Mộng Hùng, TikTok còn là lan tỏa nội dung tích cực tới cho khán giả, thông qua những điều bình dị nhất.

Từ phản ánh của báo chí, Sở ATTP TPHCM kiểm tra đột xuất nhiều cơ sở, phát hiện thực phẩm quá hạn và mở rộng kiểm tra toàn chuỗi cung ứng.
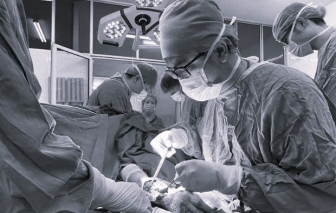
Sáng 4/2, thông tin từ Bệnh viện Hữu nghị Việt Đức, đơn vị này vừa tiếp nhận một cụ bà bị chó tấn công nguy hiểm tính mạng.
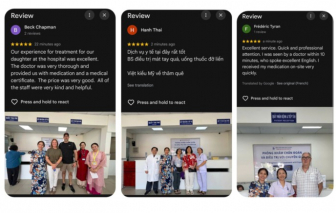
Không chỉ nhận được sự tin tưởng của người dân thành phố, mà còn thu hút khách nước ngoài, Việt kiều đến khám, điều trị và đánh giá cao.
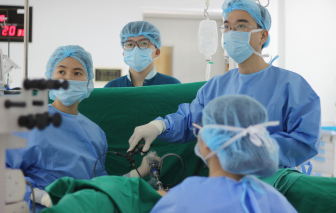
Chị Trà (38 tuổi) đã được các bác sĩ Bệnh viện Đa khoa Vinmec Phú Quốc nội soi xử lý kịp thời khuyết sẹo mổ lấy thai...

Việc ông bà giúp đỡ con cái chăm sóc cháu mang lại lợi ích sức khỏe bất ngờ cho chính người cao tuổi.

Gần tết, nhu cầu làm đẹp tăng nhanh, nhiều giá cả, khuyến mãi, làm cho người làm đẹp tìm đến cơ sở không uy tín, rồi phải vào bệnh viện...

Kiểm tra 121 nhà hàng tiệc cưới, Sở ATTP TPHCM phát hiện một cơ sở vi phạm giấy phép an toàn thực phẩm hết hiệu lực và xử phạt 25 triệu đồng.

Sáng 3/2, dự án Trung tâm Nghiên cứu ứng dụng Đông y - Đông dược chính thức được xây dựng tại Viện Y dược học Dân tộc TPHCM.

Cách nhập viện 1 ngày, em D. bị sốt, nhức đầu nên uống thuốc hạ sốt và đi học, sau đó choáng váng, khó thở, rơi vào nguy kịch.

Ngày 2/2, Cục An toàn thực phẩm cho biết đã có công văn gửi Sở Y tế tỉnh Đồng Tháp sau vụ 2 người tử vong nghi do ngộ độc rượu.

Chiều 2/2, Bộ Y tế, Bộ Nông nghiệp và Môi trường, Bộ Công thương đồng chủ trì Hội nghị phổ biến Nghị định 46/2026/NĐ-CP và Nghị quyết 66.13/2026/NQ-CP.

Trẻ khoảng 7 tuổi hoàn toàn có thể làm quen với pickleball. Tuy nhiên, phụ huynh không nên chủ quan, bởi hệ xương khớp của trẻ còn non và đang phát triển.