PNO - Trong số các loại thuốc được Cục quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận vào giai đoạn giữa năm 2001 và 2010, gần 1/3 gặp vấn đề về an toàn sau khi bán ra thị trường.
| Chia sẻ bài viết: |
Theo Sở Y tế TPHCM, hiện đã có tổng cộng 304 người bị ngộ độc sau ăn bánh mì cóc, hiện tất cả đều ổn định.

Giải Pickleball Báo Phụ Nữ TPHCM lần thứ ba năm 2025 đã chính thức khép lại trong không khí sôi động và đầy cảm xúc.

Nhiều công nhân nghi bị ngộ độc thực phẩm sau bữa ăn trưa tại bếp ăn tập thể Công ty TNHH Joint Well Việt Nam có trụ sở đóng tại TP Huế.

Những người ở độ tuổi 30-40 huyết áp trung bình cao vẫn có thể đối mặt với nguy cơ bị nhồi máu cơ tim hoặc đột quỵ cao hơn khi về già.

Từ bệnh án điện tử đến quản lý dữ liệu, các bệnh viện TPHCM đang đẩy mạnh chuyển đổi số để phục vụ người dân tốt hơn, giảm tải cho hệ thống…
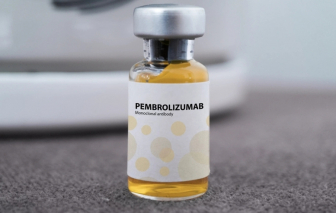
Thuốc Pembroria được bào chế dưới dạng dung dịch đậm đặc pha dung dịch tiêm truyền, có hạn sử dụng 24 tháng kể từ ngày sản xuất.

Bé trai 12 tuổi tự làm thí nghiệm với cồn. Nghe tiếng kêu cứu, gia đình phát hiện lửa bốc lên từ người bé nên dập lửa, đưa bé đi cấp cứu.
ThS.BS Nông Ngọc Sơn không chỉ là người ra quyết định điều trị, mà còn cùng đồng nghiệp thiết kế quy trình chăm sóc toàn diện cho bệnh nhân ung thư...

Sau tai nạn, người đàn ông nhập viện với vết thương chạy từ môi đến vùng thái dương trái làm "bửa đôi" nửa mặt trái.

Nghiên cứu mới cho thấy, các mạch máu võng mạc có thể giúp dự đoán nguy cơ mắc bệnh tim và tốc độ lão hóa của mỗi cá nhân.
Đặc biệt, trong 12 ca ghép mô, tạng, có bệnh nhân được ghép phổi thành công. Đây là ca ghép phổi đầu tiên ở khu vực phía Nam.

Vinamilk Green Farm khẳng định vị thế tiên phong trong cuộc đua đón đầu xu hướng tiêu dùng với dòng sữa mới, mở ra lối đi độc đáo...

Cục An toàn thực phẩm có văn bản gửi Sở An toàn thực phẩm TPHCM về việc điều tra, xử lý vụ việc 230 người nhập viện sau khi ăn bánh mì.

Đại biểu Trần Thị Nhị Hà đề nghị cấm bày bán, quảng cáo thực phẩm có hại cho sức khỏe xung quanh khuôn viên trường học, tương tự như tại Hàn Quốc.
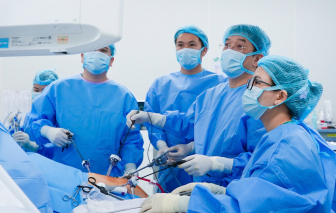
Vinmec vừa ghi dấu ấn mạnh mẽ với ca mổ ghép gan thị phạm phức tạp từ người hiến sống và loạt báo cáo chuyên sâu về tiến bộ kỹ thuật.
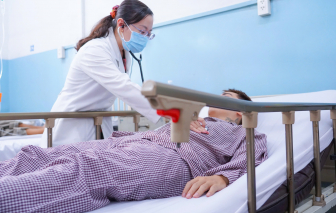
Ngày 10/11, số người ngộ độc sau khi ăn bánh mì ở TPHCM đã tăng lên hơn 230 ca bệnh, người ngộ độc được cấp cứu rải rác hơn 10 bệnh viện.
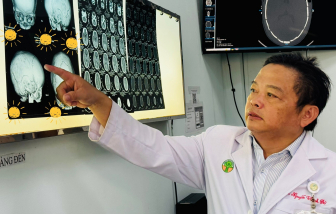
Khi vừa được sinh ra, đầu của bé C. có dấu hiệu méo dần, bé được chẩn đoán dính khớp sọ phải phẫu thuật điều trị.

Sáng 10/11, Sở Y tế TPHCM cho biết Bệnh viện Từ Dũ cơ sở 2 tại Cần Giờ chính thức đi vào hoạt động.